수처리 흡착 환경소재 활용을 위한 몽골 광산 폐기물 회수잔사 물리화학적 특성 평가 및 표면개질 연구
Abstract
Pollution and shortage of drinking water due to climate change are increasing all over the world. Especially, in Mongolia, even though lack of water and low ground water level by high dependency on ground water, concentration of heavy metal in ground water is severe due to lack of water treatment facilities. Furthermore, huge amount of mine waste such as minerals and heavy metals in soil is caused by mining activities in Mongolia. In this study, we analyzed physicochemical characteristic of Mongolia mining waste soil and studied a simple approach for synthesis of modified sand with poly(methacrylic acid) and iron-oxide in order to recycle waste sand such as adsorption media for water treatment. The adsorption ability of the waste sand modified with poly(methacrylic acid) toward Fe(II) and Mn(II) was studied and the results compared with these for iron-oxide-coated sand. The poly(methacrylic acid) modified sand showed good ability of adsorption. Moreover, it was revealed that this media was able to improve adsorption ability by operating condition.
Keywords:
Physicochemical characteristic, Mongolia mining waste, Adsorption, Water treatment키워드:
물리화학적 특성, 몽골 광산 폐기물, 흡착, 수처리1. 서 론
몽골의 경제 주축은 광물자원 개발사업으로 국내 총생산의 20.7%, 총 산업생산의 63%, 총수출의 90%를 차지하고 있으며, 석탄 1,750억 톤, 구리정광 5,500만 톤, 청광석 15억 톤 등이 매장되어 있고, 2014년 전체 수출 중 석탄, 동, 철광석, 금 등 4개 광물이 전체 수출의 83%에 이르며, 이중 석탄과 동에 대한 수출의존도가 높은 나라이다. 몽골 정부는 연간 생산규모가 GDP의 5% 이상 광산을 ‘전략광산’으로 지정하여 현재 15대 전략광산을 지정하여 운영하고 있다. 더불어 몽골 내 희토류 관련 광산은 5개, 노두 264개가 탐사되었으나, 기술부족, 환경오염 우려 등으로 인해 공식적인 희토류 채광은 아직 없는 상황으로, 미국 지질조사국에 따르면, 몽골 내 희토류 매장량이 3,100만 톤으로 추정되며, 세계 희토류 매장량의 16.77%를 차지하고 있는 것으로 예측되고 있다.
몽골의 광해를 광종과 광물에 따라 구분한다면, 금속광물인 금(Au)의 경우, 사금과 석금의 개발형태에 따라 분류할 수 있으며, 주요 사금생산지역은 울란바타르 북서쪽 약 300 ㎞ 지점에 위치한 자마르 지역으로 약 50여개의 사금광산이 밀집되어 있어 있으며, 불법개인개발업자를 포함하면 그 수를 정확히 파악할 수 없는 상황이다. 이 지역은 현재 툴강 상류 보호 정책으로 많은 광산들이 폐광을 하고 있는 상태로 발생한 주요 광해는 사금 채굴에 따른 산림훼손, 사금회수를 위한 토양 세척 시에 발생하는 수질오염, 운반과정에서 발생하는 먼지날림, 폐석유실, 채굴적의 붕괴에 의한 지반침하 등이 발생되고 있으며, 광물찌꺼기에 의한 광산주변지역의 토양오염이 중금속으로 심각하게 오염되고 있는 상황이다.
또한 몽골 구리광산 중 하나인 에르데넷 광산은 광미댐에 4억 톤의 광미 및 1,500만 ㎥의 상청액(supernatant)이 적치되어 있고, 광미 침출수로 인해 댐 주변 토양 및 수질오염 우려, 지하수 오염이 우려되는 상황이다.(1~3) 더불어 매년 1,000~1,200만 톤의 저품위 광석을 폐석장에 적치, 이로 인한 주변 토양오염이 우려되고 있다. 이에 광산 자체적으로 수질모니터링을 실시하는 것으로 파악되고 있는데, 모니터링 현황 등을 교차 점검하여 보다 체계적인 조사가 반드시 필요한 상황으로 파악되고 있다.(4~6)
또한, 몽골의 경우, 1인당 소비되는 물의 양은 4~8 L/일로 WHO 최소 소비량 규정을 비롯한 세계 평균보다도 낮은 수준이다. 이는 지하수를 이용한 먹는물 공급 의존도가 높은 특성에 따라 지하수위의 저하 및 수자원 부족 문제에서 기인하는 것으로 나타난다. 이와 더불어, 하수도 처리시설의 미비와 광산 지역의 토양오염으로 인한 지하수 내의 미네랄 및 중금속 함유량이 높게 나타나는 문제점도 안고 있다.(7,8)
이에 본 연구에서는 광산 개발 후, 무분별하게 적치되거나, 버려지는 광미(광산 폐기물)에서 발생되는 회수잔사의 재활용 가능성과 잔사의 무해화를 평가하기 위해, 몽골 광산 내 토양, 폐석, 석탄 내 주요 중금속 함량을 분석하였고, 광미 회수잔사를 대상으로 정성, 정량분석을 실시하였다. 이를 바탕으로 회수잔사의 표면 개질을 통하여 중금속 흡착이 가능한 환경소재로의 재활용 가능성을 확인하였다.
2. 연구방법
2.1 몽골 광산 환경 현황 조사
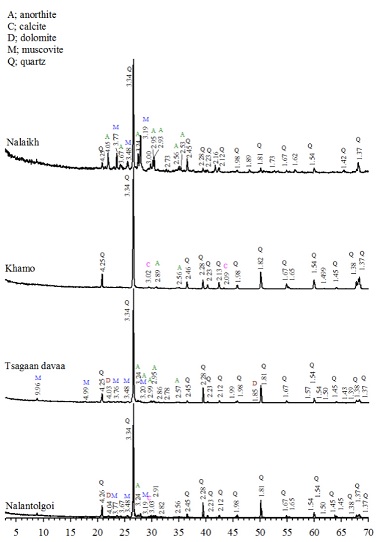
몽골 광산은 총 4개 지역을 대상으로 실시하였으며, Khamo, Tsagaan Davaa, Nalaikh, Narantolgoi광산으로 구체적으로 Khamo광산은 몽골정부와 SDC, 몽골광산주협회(Khamo)가 공동으로 수은을 사용하지 않는 친환경 금광개발을 목표로 시설 설립된 광산이다. Nalaikh광산은 울란바타르 Nalaikh dureg에서 나동쪽 2 ㎞에 위치해있고, 도심지 인근지역으로약 2만 명 이상의 주민이 거주하고 있다. 1900년대 초 최고의 대규모 지하개발 광산으로 1960년대까지 석탄 수급의 중요한 역할을 하였고, 연간 약 60~80만 톤 규모의 석탄을 채굴하는 광산이다. Nalaikh광산은 대규모 노천 채굴적이 재 매립되지 않은 채 방치되어 토지훼손과 생활폐기물 등의 불법 매립장이 되고 있는 실정이다. 또한 폐석의 방치로 인해 미관을 해치고 주변 토양오염 및 지하수, 인근 하천의 수질오염도 우려되는 상황이며 수백 개의 수직갱 또는 사갱을 통한 불법 채굴현장이 산재하여 환경적으로 상당히 위험한 상황이다. 본 연구에서는 대상 지역의 중금속 분석과 함께 광산 폐기물 회수잔사의 정성적 특성을 파악하기 위한 XRD (X-ray Diffractometer, Bruker AXS GmbH D2 PHASER) 정량적 특성을 파악하기 위한 XRF (X-ray Fluorescence Spectrometer, Bruker AXS GmbH S2 RANGER) 분석을 진행하여 재활용 가능성을 확인하고자 하였다.
2.2 회수잔사의 재이용을 위한 개질 방법
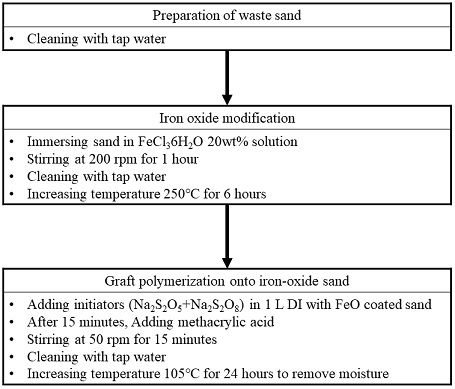
회수잔사를 환경소재로 재활용하기 위하여 산화철 코팅 및 접목중합을 통한 표면개질을 실시하였다. 접목중합을 이용한 산화철 표면개질방법은 개발도상국에서도 쉽게 적용할 수 있으며, 산업계에서도 보편적으로 이용되는 고분자 합성방법으로 개발도상국을 타겟으로 개발하기 적합할 것으로 판단된다.(9) 실험을 위해서 Sigma-Aldrich 社(USA)의 methacrylic acid(MA)와 Na2S2O8, Na2S2O5, FeCl3가 이용되었다. 중금속 흡착 환경소재를 평가하기 위한 흡착 대상물질로는 철과 망간을 선택하였으며, Samchun chemicals 社(한국)의 FeSO47H20, MnSO4H2O 시약으로 용액을 제조하여 실험을 진행하였다.
접목중합을 위한 1단계로 회수잔사 표면에 산화철 코팅을 통한 표면개질을 진행하였다. 세척한 회수잔사를 FeCl3 용액 (20 wt%)에 담지 및 교반기(SCILOGEX, SK-O330-Pro)를 통해 200 rpm에서 1시간 동안 200 rpm으로 교반하였다. 이후 다시 세척 및 250℃에서 6시간 소성하여 산화철 개질을 진행하였다.
산화철 개질된 회수잔사를 바탕으로 2차 접목중합 개질을 진행하였다. 산화철 표면에 개시제(Initiator) 역할을 위한 Na2S2O5와 Na2S2O8 용액을 첨가하여 반응시켰다. 수중에서 발생된 SO4·, S2O5· radical은 OH radical을 유도하여 강한 산화력을 바탕으로 주변의 산화철 표면과 공극 내부의 이중결합을 끊어 불안정한 상태로 유도한다. 이 때, Methacrylic acid를 첨가하여 C=C 이중결합을 깨고 안정화를 꾀하기 위해 주변의 이온과 산화철 표면 또는 공극 내부에서 결합을 이루어 접목중합 반응을 도출하였다. 산화철 및 접목중합공정을 정리하여 Fig. 1에 정리하였다.
2.3 개질된 회수잔사의 중금속 흡착 실험
접목중합 개질된 회수잔사의 흡착 성능을 평가하기 위하여 철, 망간 두 개의 중금속을 이용하여 실험을 진행하였다. FeSO47H20, MnSO4H2O 시약으로 철과 망간 각각 5 ppm의 용액을 제조하여 이용하였으며, 50 ml 용액에 접목중합 개질된 회수잔사 1 g을 넣어 실험을 진행하였다. 실험은 교반기를 이용하여 300 rpm에서 2시간 동안 진행하였으며, 흡착 전후의 용액을 분석하기 위하여 분광광도계(HACH, DR 5000)의 standard methods (Fe: FerroVer® method, Mn: Periodate Oxidation Method)를 이용하였다.
3. 결과 및 고찰
3.1 몽골광산 토양 특성 분석
Nalaikh 광산지역의 토양분석결과를 Table 1에 정리하였다. 아래 표에서 보는 바와 같이 1급 발암물질인 비소(As)의 경우, Nalaikh 광산지역의 토양시료와 석탄시료 등은 모두 몽골의 주거지 기준치인 Precaution value(P.V.)를 초과하는 것으로 나타나 인근 지역주민의 건강에 큰 위해를 끼치고 있으며, 1지역의 일부시료에서는 비소(As)뿐만 아니라 납(Pb)도 기준치를 초과하는 것으로 나타나, 오염도가 매우 심각한 수준으로 파악되었다. 따라서 광산인근지역의 지하수를 생활용수로 이용하기 위해서는 이러한 중금속 분석 및 처리가 필요할 것으로 판단된다.
3.2 광산폐기물 회수잔사의 XRD/XRF 분석결과
4곳의 광산으로부터 발생된 광산폐기물 회수잔사에 대해 XRD를 통한 정성적 분석(Fig. 2) 및 XRF를 통한 정량적 분석(Table 2)을 수행하였다. 분석결과, 4곳의 광산 모두, 모래나 석영 등에서 대부분의 성분을 이루고 있는 SiO2성분이 최소 69.39~81.14%농도로 검출되어 대부분을 차지하고 있는 것으로 나타났으며, 세라믹 재료로 산업재 생산에 사용되는 고강도, 내마모성을 갖고 있는 Al2O3가 8.49~15.23%로 다음으로 많은 비율을 차지하고 있는 것으로 분석되었다.
산화철(III)로 알려진 Fe2O3는 2.32~3.04%, CaO는 1.03~3.52%, K2O 1.85~4.01%, 시멘트, 내화벽돌 등으로 사용이 가능한 MgO는 0.37~1.68%, Na2O는 0.46~4.39% 순으로 성분조성이 나타났다. 이밖에 기타 검출된 성분으로는 산화력이 매우 크고, 살균제, 반도체물질 등의 코팅물질로도 활용이 가능한 TiO2 0.19~0.57%, 건조제, 계면활성제 등으로 사용되는 P2O5 0.~0.29%, SO3 0~1.01%, As2O3 0~0.07%, Cr2O3 0~0.08%, MnO 0.05~0.11%, PbO 0~0.03%, BaO 0~0.03%, ZnO 0~0.13%, SrO 0.01~0.03%, Rb2O 0.01~0.05%, F 0~0.29%, CuO 0~0.14%, WO3 0~0.07%, SnO2 0~0.03%, ZrO2 0~0.02%, Cl 0~0.35%로 각각 분석되었다. 전체적인 조성결과를 토대로, 향후 건설소재(벽돌, 보도블럭, 내화재 등), 환경소재 (수처리 여재, 활성탄) 등으로 활용하기 위한 추가적인 연구가 필요할 것으로 판단된다.
3.2 개질된 회수잔사 특성
회수잔사를 수처리 흡착용 환경소재로 재활용하기 위하여 산화철 코팅 후 접목중합 반응을 통하여 회수잔서 표면에 음전하를 띄는 카르복실기를 개질하였다. 카르복실기의 유무를 확인하고자 ATR-FTIR (Nicolet spectrophotometer 5700, ThermoElectron Corp., MA)을 이용하여 스펙트럼 분석을 진행하였으며, 그 결과를 Fig. 3에 정리하였다. 분석 결과, 카르복실기를 나타내는 1670 ㎝-1 wavenumber에서 개질 전 회수잔사에 비하여 표면에 접목중합된 것을 확인할 수 있었다. 하지만 기존 접목중합을 통한 제올라이트 개질에 비하여 상대적으로 낮은 값을 형성한 것으로 보아(9), 제올라이트 자체의 극성을 띄는 성질이 일반 회수잔사에 비하여 접목중합에 유리한 것으로 판단되며, 차후 작용기의 생성량을 높이기 위한 접목중합 프로세스의 개선이 필요할 것으로 판단된다.
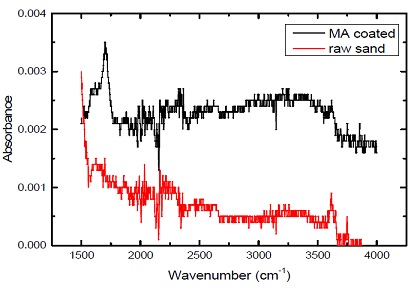
FT-IR analysis of raw and surface modification sand by graft polymerization using methacrylic acid (MA) after iron oxide coated
이를 더 정량적으로 평가하기 위하여 중금속 초기농도 5 mg/L에서 개질된 회수잔사 투입량 별 실험을 수행하여 얻어진 데이터를 Freundlich와 Langmuir model에 적용한 등온흡착실험 결과를 Table 3에 나타내었다. 개질된 회수잔사로의 중금속 흡착은 Freundlich보다 Langmuir model에 적합한 것으로 나타났다. 따라서 개질된 회수잔사의 중금속 흡착은 흡착제의 단층(mono-layer)으로 균일한 흡착이 이루어짐을 추정할 수 있다.(10)
3.3 개질된 회수잔사의 흡착 성능 평가
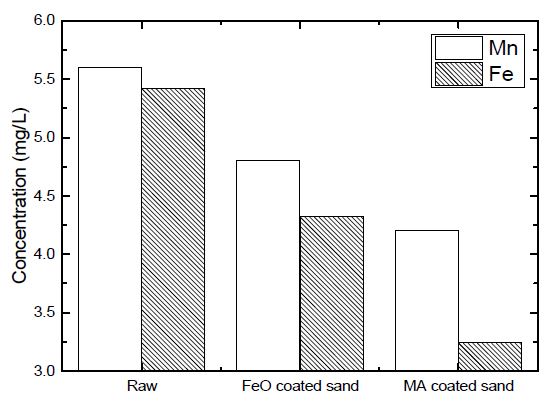
실험을 진행한 결과 개질된 회수잔사를 이용하여 철과 망간 두 종류의 중금속 모두 흡착성능을 확인할 수 있었다 (Fig. 4). 특히 산화철 개질만을 진행한 회수잔사에 비하여 접목중합 개질을 통한 회수잔사의 흡착량이 더 우수한 것으로 나타났다. 이는 산화철 코팅만으로는 철 성분의 용출 가능성으로 인한(11) 성능 및 제거효율 저하를 야기하는 것으로 판단된다.
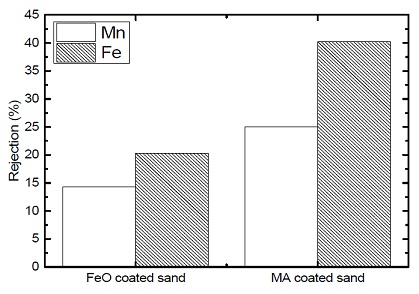
제거율 측면에서도 산화철 개질에 비하여 접목중합 개질을 통한 회수잔사의 성능이 우수한 것으로 나타났다 (Fig. 5). 하지만 먹는물 수질기준을 만족하기에는 추가적인 성능향상이 필요할 것으로 판단되며, 개질 조건을 통한 성능 개선 및 흡착 운영조건의 조정을 통한 개선을 통하여 회수 잔사를 수처리 환경소재로 재이용하기에는 효율성이 충분히 있을 것으로 사료된다.
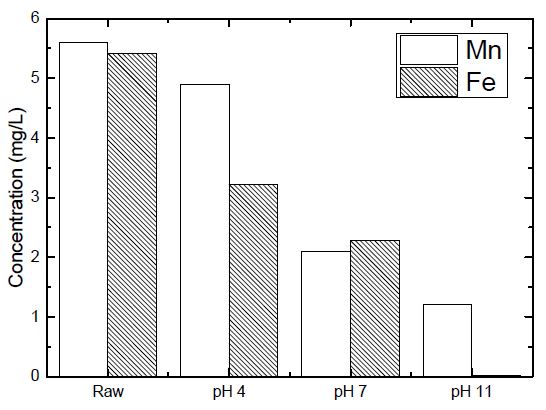
추가적으로 실험 조건 중 pH를 변화하여 중금속 흡착 실험을 진행한 결과를 Fig. 6에 나타내었다. 그 결과 pH가 높을수록 제거효율이 뛰어난 것으로 나타났다. 하지만 pH 11의 조건에서는 용액 내 철과 망간 이온이 모두 용출되어 침전하는 것으로 나타나 흡착에 의한 제거로 보기는 어려운 것으로 판단된다.(11,12) 접목중합 개질된 회수잔사를 흡착용 수처리 환경소재로 이용하기 위해서는 소재 자체가 산상을 띄고 있기 때문에 운영시 pH 조정을 통한 흡착 효율 향상이 가능할 것으로 판단된다.
4. 결 론
본 연구의 결과를 요약하면 다음과 같다.
- 1) 중금속 분석결과, 비소(As)와 납(Pb) 등이 몽골 내 기준치를 초과하는 것으로 나타나, 인근 환경오염에 기여하는 것으로 확인되었으며, 이에 대한 환경제어가 필요할 것으로 판단된다.
- 2) 광산폐기물 회수잔사에 대한 정성/정량 분석결과, SiO2 성분이 가장 높은 비율로 검출되었고, Al2O3, Fe2O3, CaO, MgO 등이 분석되었고, 이러한 결과를 토대로, 향후 건설소재, 수처리 여재, 첨착활성탄 제조 등 재활용 소재로 활용하기 위한 추가적인 연구가 필요할 것으로 판단되었다.
- 3) 회수잔사를 수처리 흡착용 환경소재로 재활용하기 위해 산화철 코팅 및 접목중합을 통한 표면개질을 진행한 결과 회수잔사 표면에 극성의 카르복실기가 형성된 것으로 확인되었다.
- 4) 표면개질된 회수잔사는 수계 내 이온성 오염물질인 철과 망간을 흡착하는데 효과적인 것으로 나타났으며, pH 조정과 같은 운영조건의 변화로 인하여 성능이 향상됨을 확인할 수 있었다.
- 5) 이를 바탕으로 향후 표면개질공정의 개선과 최적운영조건 도출을 통하여 몽골 광산 폐기물에서 발생하는 회수잔사를 이용한 수처리 흡착용 환경소재 개발이 가능할 것으로 판단된다.
Acknowledgments
2019 한국유체기계학회 하계학술대회 발표 논문, 2019년 7월 3일~7월 5일, 휘닉스 평창
본 연구는 한국에너지기술평가원의 산업기술혁신사업 중 “에너지국제공동연구사업(20188500000510)”과 환경부의 “환경시설 재난재해 대응기술개발사업(2019002860001)”의 지원을 받아 수행된 연구결과이며, 이에 감사드립니다.
References
- Park, J. H., Park, J. H., Kim, T. H., and Yeon, G. H., 2018, “A Study on Heavy Metal Pollution in Mongolia Boroo Soil,” Journal of Soil and Groundwater Environment, Vol. 23, No. 5, pp. 17~25.
-
Erdem, E., Karapinar, N., and Donat, R., “The removal of heavy metal cations by natural zeolites,” Journal of Colloid and Interface Science, Vol. 280, No. 2, pp. 309~314.
[https://doi.org/10.1016/j.jcis.2004.08.028]
-
Egashira, R., Tanabe, S., and Habaki, H., 2012, “Adsorption of heavy metals in mine wastewater by Mongolian natural zeolite,” Procedia Engineering, Vol. 42, pp. 49~57.
[https://doi.org/10.1016/j.proeng.2012.07.394]
-
Egashira, R., and Bolortamir, T., 2008, “Removal of Hexavalent Chromium from Model Tannery Wastewater by Adsorption Using Mongolian Natural Zeolite,” Journal of Chemical Engineering of Japan, Vol. 41, No. 10, pp. 1003~1009.
[https://doi.org/10.1252/jcej.08we069]
-
Sevgi K., Yüksel O., Tanıl A., 2007, “Kinetics and equilibrium studies of heavy metal ions removal by use of natural zeolite” Desalination, Vol. 214, No. 1-3, pp. 1~10.
[https://doi.org/10.1016/j.desal.2006.09.023]
-
Egashira, R., Tanabe, S., and Habaki, H., 2013, “Removal of Heavy Metals from Model Mine Wastewater by Adsorption Using Mongolian Natural Zeolites,” Journal of Chemical Engineering of Japan, Vol. 46, No. 1, pp. 50~55.
[https://doi.org/10.1252/jcej.12we137]
- Yeo, I. S., An, J. S. and Park, C. G., 2018, “Study on Development and Application of Small Sized Water Treatment System using Mongolian Natural Zeolite with Improved Adsorption Performance,” Journal of Appropriate Technology, Vol. 4, No. 2, pp. 137~141.
-
Yeo, I. S., Jo, E. Y., Park, J. R., Oh, H. J., Lee, S. J. and Park, C. G., 2016, “Study on Performance Evaluation of Ion Exchange Fiber to Remove Ionic Contaminants for Customized Water Treatment System in Developing Countries,” Journal of Appropriate Technology, Vol. 24, No. 2, pp. 107~114.
[https://doi.org/10.17640/KSWST.2016.24.2.107]
-
Pak, S. H., Park, S. M., An, J. S., and Park, C. G., 2018, “Adsorption behavior of poly(methacrylic acid)/iron-oxide-coated zeolite for the removal of Mn(II), Fe(II), and As(III) from aqueous solution,” Desalination and Water Treatment, Vol. 223, pp. 150~155.
[https://doi.org/10.5004/dwt.2018.22649]
-
Hameed, B. H., Din, A. T. M. and Ahmad, A. L., 2007, “Adsorption of methylene blue onto bamboo-based activated carbon: Kinetics and equilibrium studies,” Journal of Hazardous Materials, Vol. 141, No. 3, pp. 819~825.
[https://doi.org/10.1016/j.jhazmat.2006.07.049]
- Lim, J. W., Chang, Y. Y., and Yang, J. K., 2010, “Removal of Soluble Mn(II) using Multifunctional Sand Coated with both Fe-and Mn-oxides,” Journal of Korean Society of Environmental Engineers, Vol. 32, No. 2, pp. 193~200.
- Yu, M. R., Yang, J. K., Kim, M. N., Lee, S. M., and Lee, N. H., 2007, “Evaluation of the Removal Properties of Mn(II) by Manganese-Coated sand,” Journal of Korean Society of Environmental Engineers, Vol. 29, No. 5, pp. 571~576.